Suivre les essais cliniques dans l’AMS : Alterity Therapeutics
En savoir plus...
Sur le site Clinical Trials (en anglais), retrouvez cet essai :
▪ ATH434
Alterity Therapeutics a terminé son essai clinique de phase 2.
10 à 15 patients AMS étaient concernés et 5 Centres impliqués en France.
Résultats attendus au 1ier trimestre 2025

Le suivi des personnes souffrant d’AMS intégrées dans l’essai de phase 2 d’ATH 434 est aujourd’hui terminé. Les résultats de cet essai sont attendus au cours du premier semestre 2025.
Comme c’est toujours le cas pour les essais de ‘’phase 2’’, cet essai a été mené avec un nombre réduit de patients, retenus sur des critères bien définis. Il aura concerné au niveau mondial une soixantaine de volontaires.
En France, , une quinzaine de personnes ont été sélectionnées en 2023 et suivies dans l’un des 5 Centres de référence ou de compétences impliqués : Bordeaux, Toulouse, Lille, Marseille, Paris - La Pitié-Salpêtrière.
10 à 15 personnes seront sélectionnées d’ici fin septembre 2023 puis suivies dans l’un des 5 Centres de référence ou de compétences suivants : Bordeaux, Toulouse, Lille, Marseille, Paris - La Pitié-Salpêtrière.. L’essai d’ATH 434 aura duré 54 semaines au cours desquelles les patients auront pris, par voie orale, ou bien une dose A, ou bien une dose B, ou bien un placebo.
ATH 434 cible l’excès de fer dans le cerveau
L'IRM montre, chez les personnes souffrant de la maladie de Parkinson ou d’AMS, une accumulation de fer dans certaines parties du cerveau. Le métabolisme du fer dans le cerveau est complexe. Ce fer cérébral est nécessaire. Il joue un rôle important dans la production de dopamine. Il contribue aussi à la production par les cellules gliales de l’indispensable myéline qui gaine les neurones comme un isolant. Mais s’il est présent en trop grande quantité, il interagit négativement avec l’alpha-synucléine et peut favoriser son mauvais repliement et la formation d’agrégats toxiques.
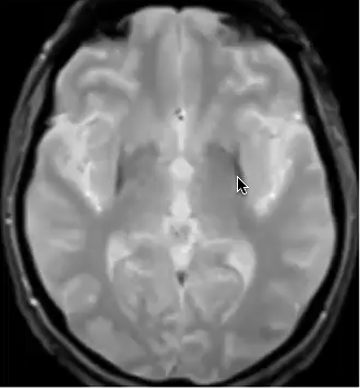
ATH434 testée en ce moment est une petite molécule qui passe la barrière hémato méningée. Elle accède facilement au cerveau où elle agit sur le métabolisme du fer. Elle a montré dans des études pré-cliniques sa capacité à inhiber l'agrégation d’αlpha-synucléine, empêcher la perte de neurones dans la substance noire et préserver les performances motrices dans des modèles animaux de la maladie de Parkinson.
Deux traces sombres apparaissent à l’IRM, l’une est fléchée, à droite.
Elles signalent une accumulation anormale de fer dans le putamen, une partie du cerveau impliquée dans la réalisation de mouvements volontaires. Cette accumulation est un facteur des symptômes comme la lenteur, la raideur et les tremblements. Son repérage à l’IRM est l’un des signes qui conduisent au diagnostic d’AMS
Mise à jour décembre 2024
▪ 6 juillet 2022 : Alterity annonce le début en Nouvelle Zélande de son essai clinique de phase 2. Les patients AMS en phase précoce de la maladie seront traités pendant 12 mois. L'étude explorera l'effet du traitement ATH434 sur l'imagerie et les biomarqueurs protéiques, tels que l'agrégation de l'αlpha-synucléine et l'excès de fer.
Lire l’article
▪ 27 avril 2022 : Les autorités sanitaires britanniques autorisent un essai clinique d’ATH434 au Royaume Uni. « Nous prévoyons d'ouvrir notre premier site d'essai clinique de phase 2 en Nouvelle-Zélande ce trimestre, puis d'étendre l'essai à l'échelle mondiale au Royaume-Uni, dans d'autres pays européens, en Australie et aux États-Unis. » indique le Dr David Stamler, PDG d'Alterity.
Lire l’article
▪ 7 avril 2022 : Alterity a fondé la préparation de cet essai sur une « étude d’histoire naturelle », bioMUSE, qu’elle mène en parallèle. Cette étude contribue à la sélection de biomarqueurs et des données cliniques qui permettront d’évaluer la pertinence de la stratégie thérapeutique. La société en présente les premiers résultats.
Lire l’article
■ Le 8 juillet 2021 : La MDS, International Parkinson and Movement Disorder Society, publie l’article de Nadia Stefanova qui conclut à l’intérêt d’engager des essais chez l’homme d’ATH434
Sous le titre « ATH434 réduit la neurodégénérescence liée à la alpha-synucléine dans un modèle murin d'AMS », la chercheuse de l’équipe du Pr Wenning à Innsbruck rend compte de façon très positive de l’étude pré-clinique d’ATH434 réalisée sur des souris AMS.et se félicite de l’approbation par l’Agence des critères d’évaluation proposés.
Lire l'article
■ Le 23 juin 2021 : Alterity annonce avoir reçu des conseils de l’Agence européenne du médicament pour l’organisation fin 2021 de son essai clinique de phase 2 d’ATH434 dans l’AMS et se félicite de l’approbation par l’Agence des critères d’évaluation proposés..
Lire le communiqué
■ Le 9 février 2021 : Alterity Therapeutics annonce un financement de la Michael J.Fox Foundation pour l'optimisation de la dose d'ATH434 en vue d’essais cliniques dans la maladie de Parkinson.
Le financement de 495 000 $ US est destiné à l’évaluation du profil pharmacologique d'ATH434 dans un modèle primate afin de déterminer la dose optimale d'ATH434 dans les futurs essais cliniques sur la maladie de Parkinson.
Lire le communiqué
■ Le 9 décembre 2020 : interview sur Finance News Network de Geoffrey Kempler, PDG d’Alterity
Il évoque l’organisation avec des patients AMS de « l'essai de phase 2 qui suivra l'étude bioMUSE. (...) Actuellement, nous prévoyons 60 patients pendant six mois, en Europe et en Amérique. », et des perspectives financières attractives : « Jusqu'à 725 millions de dollars. Je soulignerai que c'est en dollars américains, et ce n'est qu'en Amérique, et ce n'est que pour l'atrophie multi-systématisée. Il est clair que nous le commercialiserons dans le monde entier, et selon la façon dont le médicament fonctionne, s'il traite l'atrophie multi-systématisée et qu’il est approuvé pour cela, il est très probable que les médecins envisageront son utilité dans d'autres troubles parkinsoniens, y compris la maladie de Parkinson elle-même ».
Lire le communiqué : 2020-12-09
■ Le 27 octobre 2020 : Alterity recrute des patients atteints d'AMS pour l'étude bioMUSE.
BioMUSE est une « étude d'histoire naturelle » qui suivra pendant un an l’évolution de la maladie chez des patients atteints d’AMS. Cette étude comportera examen neurologique détaillé, échelles d'évaluation clinique des symptômes moteurs, autonomes et des activités de la vie quotidienne, ainsi qu'une neuroimagerie spécialisée et une évaluation des biomarqueurs protéiques dans divers échantillons biologiques.
Les données de bioMUSE seront utilisées pour préparer la sélection des patients dans le prochain essai clinique de phase 2 d'Alterity sur ATH434 pour le traitement de l’AMS.
Lire le communiqué
■ 4 août 2020 : Nadia Stefanova, professeur de recherche translationnelle sur la neuro-dégénérescence à l'Université de médecine d'Innsbruck, confirme les résultats des études précliniques sur ATH434.
Au terme de nouvelles expériences menées sur un modèle animal d'AMS, il apparaît que l'ATH434 réduit la pathologie de l'α-synucléine, préserve les neurones et améliore les performances motrices. Ce travail a eu lieu dans la division neurologie sous la responsabilité du Pr. Gregor Wenning, cofondateur du groupe d'étude européen AMS.
Lire le communiqué
■ 30 juin 2020 : Alterity échange avec la Food and Drug Administration US pour préparer un essai clinique de phase 2 d’ATH434
Lire le communiqué
■ 21 mai 2020 : Alterity a présenté des données issues de son essai clinique de phase 1 sur ATH434 pour le traitement de l'atrophie multisystématisée lors de la réunion virtuelle de l'American Academy of Neurology (AAN).
Lire le communiqué
■ 30 avril 2020 : Alterity reçoit le label « médicament orphelin » de la Commission européenne et présente ses résultats financiers du 1ier trimestre.
Lire le communiqué : 2020-04-30
■ 7 février 2020 : Alterity THERAPEUTICS sous surveillance au NASDAQ : la société n'est actuellement pas conforme aux règles qui veulent que les titres cotés maintiennent un cours acheteur minimum de 1 $US par action. Alterity dispose d’un délai de 180 jours, jusqu'au 3 août 2020, pour retrouver la conformité à l'exigence de prix minimum, comme indiqué dans les règles de cotation du NASDAQ.
Lire le communiqué
■ 18 novembre 2019 : Alterity a reçu un avis favorable du Comité des médicaments orphelins (COMP) de l'Agence européenne des médicaments, première étape vers la désignation par la Commission européenne (CE).comme médicament-orphelin de sa molécule principale PBT434 pour le traitement de l'atrophie multi-systématisée (AMS).
Lire le communiqué
■ 6 mai 2019 : Avant la fin de son essai clinique de phase 1 sur volontaires sains du PBT434, Prana Biotechnology devenue Alterity THERAPETICS, en présente à l’assemblée annuelle de l’American Academy of Neurologie les premiers résultats. Un power-point joint au communiqué a accompagné cette présentation.
Lire le communiqué
Voir le power-point
■ 31 janvier 2019 : Le PBT 434 de Prana Biotechnology labellisé « médicament orphelin » pour le traitement de l’AMS par la Food and Drug Adminstration.
Lire le communiqué
■ 7 octobre 2018 : Présentation au congrès international de Hong-Kong « Parkinson et troubles du mouvement » des essais précliniques du PBT434.
Lire le communiqué
■ 9 juillet 2018 : la société Prana Biotechnology annonce qu’elle va présenter lors du Congrès international sur la maladie de Parkinson et les troubles du mouvement qui se tiendra à Hong Kong du 5 au 9 octobre 2018 les résultats positifs d’essais sur des modèles animaux d’AMS de sa molécule PBT434. Elle teste cette molécule depuis juin sur des humains, volontaires sains.
Lire le communiqué
Glossaire
Alpha-synucléine
Les dysfonctionnements de l’alpha-synucléine sont à l’origine de plusieurs pathologies appelées « synucléinopathies » : l’AMS, la maladie de Parkinson, la maladie à corps de Lewy.
L’alpha-synucléine est une petite protéine abondante dans le cerveau et nécessaire à son  fonctionnement.
fonctionnement.
Pour des raisons inconnues, cette protéine peut adopter une mauvaise conformation, jusqu’à former des agrégats. Ces agrégats vont encombrer les neurones, mais aussi, dans l’AMS, les oligodendrocytes, ces cellules de soutien des neurones. De plus, l’alpha-synucléine mal repliée propage de cellule en cellule son fonctionnement anormal. C’est pourquoi cette protéiné encore mal connue, ses différentes souches, son mode de propagation sont la principale cible des stratégies thérapeutiques visant l’AMS et les maladies voisines.
En savoir plus :
Voir la page "Au commencemen de la recherche, les cellules oligodendriales"
Voir la vidéo « l’alpha-synucléine dans l’AMS », par Pierre-Olivier Fernagut, coordonnateur du Conseil scientifique d’Aramise.
Cellules gliales
Ce sont les cellules qui forment l’environnement des neurones. Elles jouent un rôle de soutien et de protection du tissu. Elles entourent les neurones et participent au contrôle de l'en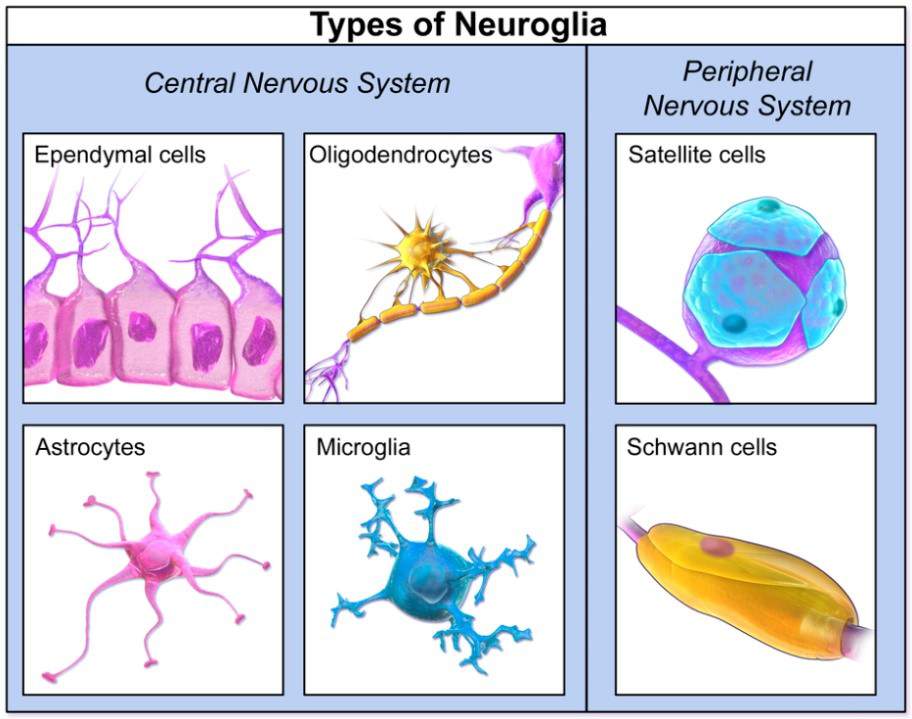 vironnement chimique et électrique en leur fournissant des nutriments, de l’oxygène et en éliminant leurs déchets. Ces cellules produisent par exemple la myéline, une substance qui sert d'isolant aux fibres nerveuses.
vironnement chimique et électrique en leur fournissant des nutriments, de l’oxygène et en éliminant leurs déchets. Ces cellules produisent par exemple la myéline, une substance qui sert d'isolant aux fibres nerveuses.
Il y aurait, dans notre système nerveux, à peu près autant de cellules gliales que de neurones, soit environ 100 milliards. Les cellules gliales sont différentes au sein du système nerveux central et du système nerveux périphérique, elles n’ont pas non plus la même origine dans leur développement.
● Les cellules gliales du système nerveux central (SNC) qui dérivent des glioblastes du tube neuronal embryonnaire, sont de 3 types :
- les astrocytes qui assurent un lien fonctionnel entre vaisseaux et neurones, apportant substrats énergétiques aux neurones et les débarrassant des produits de dégradation ;
- les oligodendrocytes à l’origine de la gaine de myéline des neurones ;
- les épendymocytes qui forment les parois qui délimitent les différentes cavités du SNC et sont responsables de la synthèse du liquide céphalo-rachidien (LCR)
● Les cellules gliales du système nerveux périphérique (SNP), dérivent des crêtes neurales embryonnaires. Ce sont les cellules satellites avec une fonction analogue à celle des astrocytes et les cellules de Schwann qui forment chacune la gaine d’un seul neurone, à la différence des oligodendrocytes qui « s’occupent » chacun d’une dizaine de neurones.
Dopamine
La dopamine est l'une des nombreuses substances chimiques qui servent de neurotransmetteurs dans le cerveau. La noradrénaline, l'adrénaline, la sérotonine et l'acétylcholine sont d'autres neurotransmetteurs. On a pu établir une relation entre le déficit en un neurotransmetteur spécifique et des troubles nerveux comme la maladie de Parkinson. La L-dopa (levodopa), prescrite dans le traitement de la maladie de Parkinson, est un précurseur direct de la dopamine qui passe la barrière hémato-encéphalique et peut être transformée en dopamine dans le cerveau.
80% des neurones 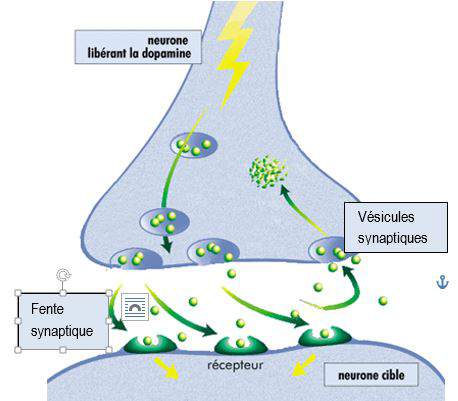 dopaminergiques contenus dans le cerveau sont situés dans la substance noire.
dopaminergiques contenus dans le cerveau sont situés dans la substance noire.
Synthétisée dans les terminaisons pré-synaptiques des neurones dopaminergiques, la dopamine est chargée dans des vésicules synaptiques qui la libèrent dans la fente synaptique à l’arrivée d’un potentiel d’action.
La dopamine libérée dans la fente est en partie captée par des récepteurs se trouvant sur la cellule postsynaptique et transmet ainsi le signal neuronal. Environ 80 % de la dopamine libérée est recaptée par les neurones dopaminergiques présynaptiques par des transporteurs sélectifs DAT (dopamine active transporter), qui contrôlent ainsi de façon précise la concentration dopaminergique, à la fois dans le temps et dans l’espace.
Voir aussi :
- voies dopaminergiques
- neurotransmetteur
- synapse
Imagerie par Résonance Magnétique
L'imagerie par résonance magnétique (IRM) est une technique d'imagerie médicale permettant d'obtenir des vues en deux ou en trois dimensions de l'intérieur du corps de façon non invasive avec une résolution en contraste1 relativement élevée. En imagerie médicale, l'IRM est principalement dédiée à l'imagerie du système nerveux central (cerveau et moelle épinière), des muscles, du cœur et des tumeurs.
En savoir plus sur Wikipédia : Wikipédia
MDS
Movement Disorder Society
International Parkinson and Movement Disorder Society
L'International Parkinson and Movement Disorder Society (MDS) est une société savante internationale. Basée à Milwaukee, aux USA, elle rassemble plus de 11 000 cliniciens, scientifiques et professionnels de la santé qui se consacrent à l'amélioration des soins aux patients atteints de troubles du mouvement, maladie de Parkinson et autres troubles parkinsoniens, dont l’AMS. https://www.movementdisorders.org/
Le Professeur Meisner fait partie de son Comité exécutif.
Un groupe de travail international spécifique sur l’AMS existe au sein de la MDS :
En font partie, pour la France, Erwan Bezard, Pierre-Olivier Fernagut, Anne Pavy-LeTraon, Wassilios Meissner, Ronald Melki, Francois Tison, Olivier Rascol.
Pour la révision des critères diagnostiques de l’AMS, une task-force co-présidée par l’Autrichien Gregor Wenning et l’Américain Horacio Kaufmann a été créée au sein de la MDS :
La MDS a créé des « sections régionales » sur les différents continents . Margherita Fabbri est membre du Comité exécutif de la section européenne de la MDS
